Cell Genomics:结合孟德尔随机化与AlphaFold3发现阿尔茨海默病蛋白标志物及其三维结构变化
来源:生物探索 2024-12-11 11:33
阿尔茨海默病(Alzheimer’s disease, AD)是全球痴呆症的主要原因,对患者造成认知、情绪及生活能力的全面退化,同时给家庭带来沉重的经济、心理和生活压力。尽管进行了大量的研
阿尔茨海默病(Alzheimer’s disease, AD)是全球痴呆症的主要原因,对患者造成认知、情绪及生活能力的全面退化,同时给家庭带来沉重的经济、心理和生活压力。尽管进行了大量的研究工作,但AD的病因和发病机制仍然不明确,旨在阻止或延缓其临床进展的策略仍然面临巨大挑战。
近日,《Cell Genomics》在线发表了题目为Deciphering proteins in Alzheimer's disease: A new Mendelian randomization method integrated with AlphaFold3 for 3D structure prediction的突破性研究。该研究首次将孟德尔随机化(Mendelian Randomization, MR)与先进的蛋白质三维结构预测工具AlphaFold3相结合,成功揭示了驱动阿尔茨海默病发生的关键生物学机制。这项开创性研究为识别阿尔茨海默病蛋白生物标志物及治疗靶点提供了全新路径,为应对这一全球性神经退行性疾病带来了前所未有的希望。

研究团队提出了一种名为MR-SPI(Mendelian Randomization that first Selects valid genetic instruments and performs Post-selection Inference)的新方法。MR-SPI一种高效且稳健的针对蛋白组数据的因果推断方法。该方法的灵感来源于俄国著名作家列夫·托尔斯泰的“安娜·卡列尼娜原则”——“幸福的家庭都是相似的,不幸的家庭各有各的不幸”。该研究团队提出了一个重要观点:“有效的工具变量具有相似的特性,而无效的工具变量则因各种原因产生偏误。” 基于这个原则,研究团队开发出一种多数制投票(plurality voting)算法,用于精确筛选有效的遗传工具变量,克服隐藏混杂变量带来的偏差,最终帮助识别与疾病相关的蛋白标志物。这一技术有望为蛋白组学研究和复杂疾病的精准医疗提供强大支持。通过结合获得2024年诺贝尔化学奖的人工智能蛋白质三维结构预测技术AlphaFold3,研究团队开发了一套计算流程,可以高精度地将基因变异与蛋白质的结构变化联系起来。
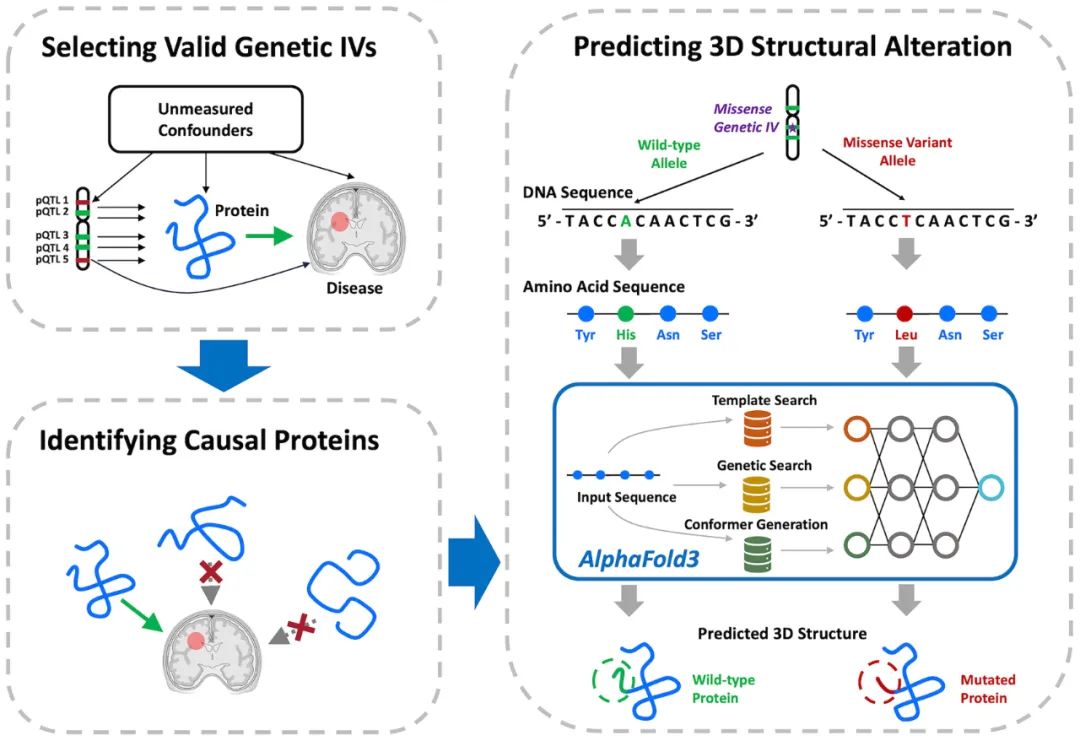
计算流程概述(Credit: Cell Genomics)
在研究中,作者利用来自 54,000 多名 UK Biobank 参与者的全基因组蛋白组学数据,以及涵盖 455,258 名个体(其中包括 71,880 名阿尔茨海默病患者)的全基因组关联研究(GWAS),成功识别出 7 种关键蛋白——TREM2、PILRB、PILRA、EPHA1、CD33、RET 和 CD55。这些蛋白不仅在阿尔茨海默病的因果机制中起到重要作用,还因错义突变而发生显著的蛋白三维结构变化。研究揭示了这些基因变异如何破坏蛋白功能,从而可能引发疾病的发生和进展。
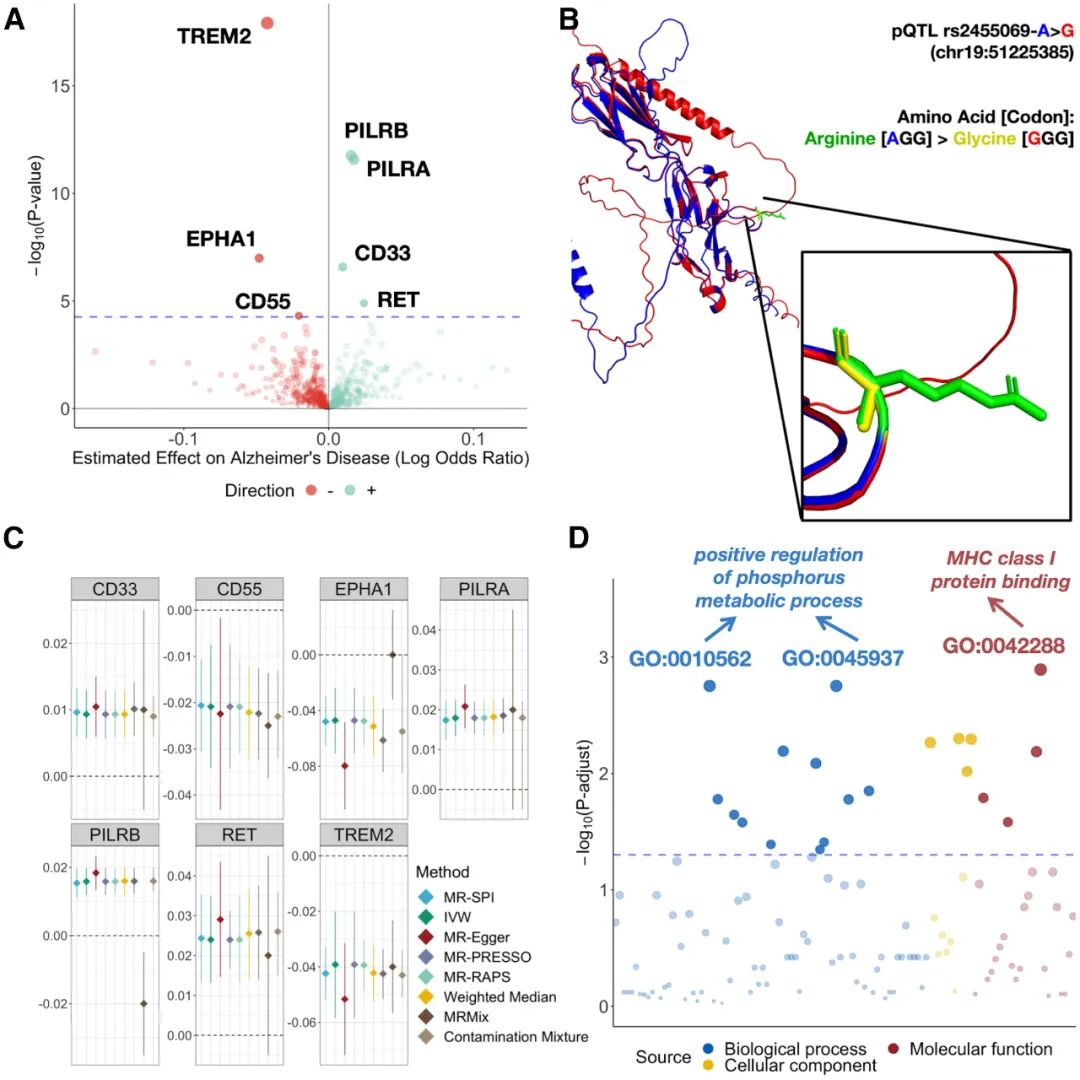
与阿尔茨海默病相关的蛋白标志物的因果效应估计和蛋白三维结构变化预测(Credit: Cell Genomics)
综上所述,该研究展示了如何通过整合基因组和蛋白组学数据、因果推断与先进人工智能蛋白质三维结构预测工具,填补该领域的关键空白,为阿尔茨海默病的下一代研究奠定了坚实基础。通过识别蛋白标志物的三维结构变化,促进了对疾病关键通路的靶向干预研究,为精准医学带来了新可能。
哥伦比亚大学生物统计系的刘中华教授是本文的通讯作者,罗格斯大学统计系的郭子剑教授是文章的共同通讯作者,香港大学统计系的尧旻昊博士生是本文的第一作者。合作者是哥伦比亚大学Gary W. Miller教授,Badri N. Vardarajan教授和哈佛大学Andrea A. Baccarelli教授。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


